Nonostante l’enorme diffusione avuta nella disinfezione dell’acqua di piscina da parte di questo tipo di prodotti, ancora poco o nulla si sa della loro azione e della loro reale efficacia.
Le ditte che commerciano prodotti disinfettanti per piscina spingono ormai da anni nella direzione praticamente univoca dei prodotti clorati a base di acido cianurico, per vari motivi tra i quali:
– Il costo più elevato rispetto ad altri prodotti, ed il conseguente maggiore ricavo
– L’estrema facilità di trasporto e di stoccaggio
– La durata del prodotto, che non si deteriora anche per lunghi periodi
Il fatturato globale è enorme, difficilmente quantificabile; negli Stati Uniti si parla di trecento milioni di dollari l’anno. Si tratta quindi di prodotti molto diffusi e facilmente reperibili sul mercato.
Ma proviamo ad analizzare più in dettaglio di quanto si faccia di solito di che cosa si tratta.
L’acido cianurico è, come dice il nome, un acido, seppure piuttosto debole (il termine chimico è s-triazina-trione). In associazione con cloro prende la forma di due prodotti, chiamati rispettivamente bi- e tri- cloroisocianurato. Viene venduto in forma granulare, di polvere bianca piuttosto lenta a sciogliersi.
Il tricloroisocianurato può essere compattato sotto forma di pastiglie più o meno grandi, forma nella quale è più conosciuto.
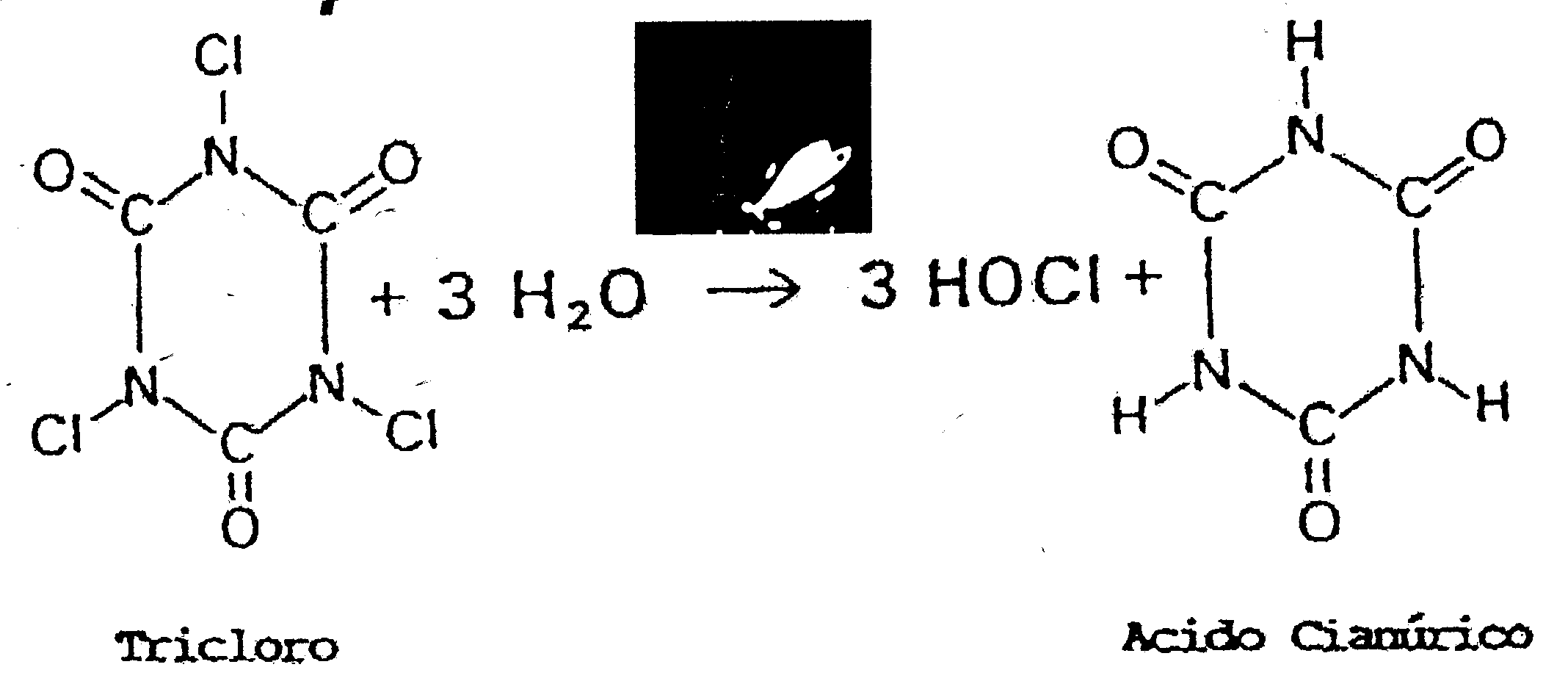
In associazione con l’acqua i prodotti a base di acido cianurico (detti anche isocianurati) si scindono in acido ipocloroso e acido cianurico, secondo le formule allegate:
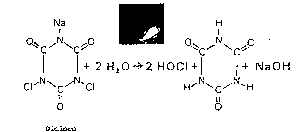
Il dicloro ha un contenuto in cloro utile del 55-63% (la percentuale di cloro utile viene misurata in relazione a quella del cloro gas, che è del 100%. Una parte per milione di cloro gas dà una parte per milione di cloro residuo, mentre per avere una parte per milione di cloro residuo utilizzando dicloro è necessario introdurne 1.6 parti, pari a 1/62%).
Il dicloro ha forma granulare, è relativamente pesante e lento da sciogliere. Per introdurlo in piscina attraverso una pompa dosatrice è necessario diluirlo precedentemente in un recipiente con acqua.
Ha un PH non troppo basso, poiché, come si vede dalla formula chimica della reazione con l’acuqa, oltre all’acido cianurico libera anche NaOH, sostanza basica con elevato ph.
Sciolto in acqua in concentrazione pari all’ 1% produce una soluzione a ph di circa 6.0.
Il 57% del suo peso è costituito da acido cianurico.
Il tricoloro ha un contenuto in cloro utile più elevato, intorno al 90%. Molto vicino quindi a quello ideale del cloro gas.
E’ costituito in forma di polvere finissima, il più delle volte compattato in pastiglie, che possono venire introdotti in speciali “lambitori”, che erodono il cloro un poco alla volta a seconda della necessità.
Il ph del tricloro è molto basso, intorno a 2.8 .
Contiene il 54% in peso di acido cianurico.
Come abbiamo visto, la differenza fondamentale tra questi prodotti ed altri a base di cloro è la presenza nella formula di acido cianurico.
Questa sostanza viene spesso definità “stabilizzante”, poiché è in grado di rallentare l’azione dissociativa dell’acido ipocloroso da parte dei raggi ultravioletti del sole. Questi prodotti possono infatti essere definiti “gli occhiali da sole del cloro”.
L’acido ipocloroso HClO si dissocia infatti in H+ e OCl– in base a vari fattori, tra cui il ph dell’acqua. tra questi fattori ci sono anche i raggi ultravioletti, che facilitano questa dissociazione. In realtà l’acqua è un continuo cambiare di situazioni di associazioni e dissociazioni. L’attività degli ioni idrogeno, che si legano e si slegano continuamente, definisce il valore del potenziale redox.
L’acido cianurico tiene legate le molecole di acido ipocloroso, che non si scindono più così facilmente, riducendo il valore del potenziale redox.
Il problema principale derivato da questo effetto chimico è una ridotta capacità del cloro contenuto nell’acqua di piscina a svolgere le proprie funzioni di ossidazione e disinfezione.
|
|
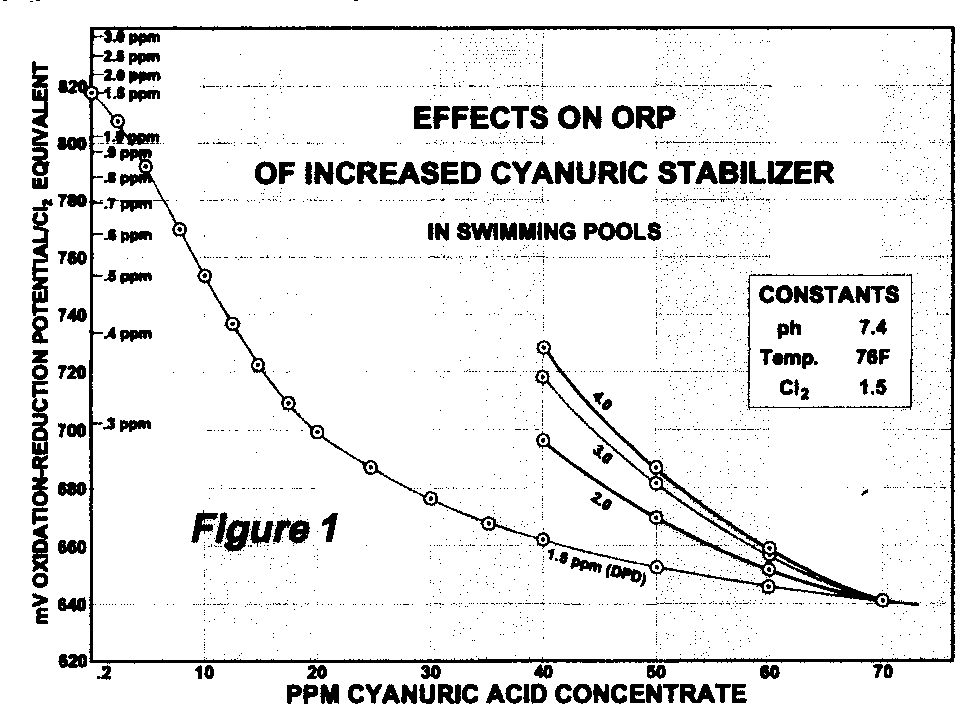
Nella figura vengono riportati i valori di potenziale redox in funzione dei ppm di acido cianurico, per diversi valori di cloro libero.
Come si può vedere, nella curva a cloro 1.5 ppm il valore di potenziale redox si abbassa da 820 mV senza acido cianurico a 640 mV con un valore di acido cianurico di 70 ppm. .
Quest’ultimo valore si comporta da “soglia” anche per le curve con cloro libero più alto, che si congiungono tutte nello stesso punto.
I dati sono stati ottenuti con ph 7.4 . (Da un articolo di Kent Williams, 1997)
La riduzione di potenziale redox da 820 mV a 640 mV è in grado di rallentare di molto (fino alla metà) l’azione di ossidazione e disinfettante dell’acqua di piscina, come dimostrano vari studi sull’argomento.
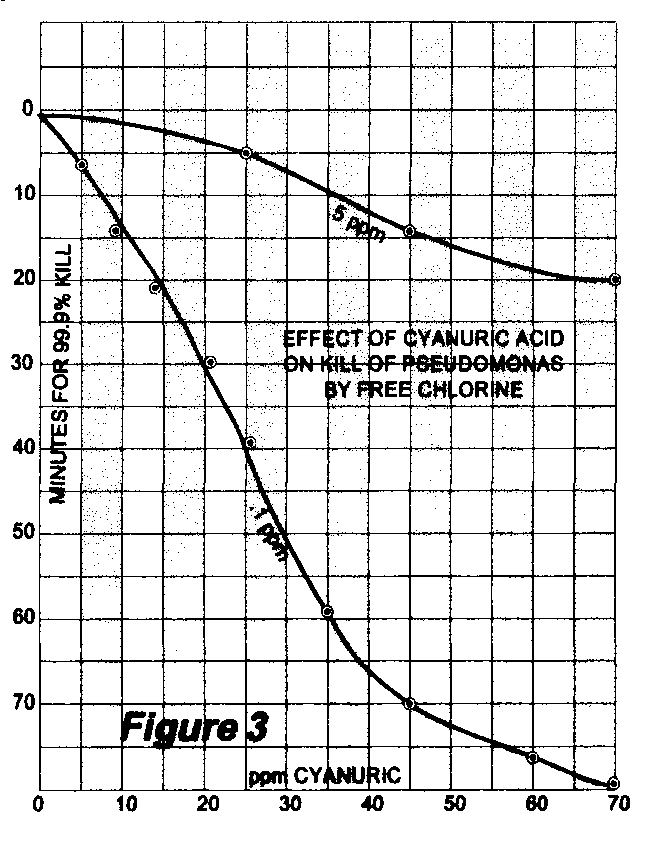
Un’articolo pubblicato in Applied Microbiology nel 1966 prende in considerazione l’effetto della concentrazione dell’acido cianurico sul tempo di in attivazione del batterio Pseudomonas.
Nell’articolo vengono prese in esame concentrazioni di cloro molto basse, di 0.1 e 0.5 ppm rispettivamente, ma il grafico rende comunque l’idea se non dei reali tempi di in attivazione da parte di un’acqua di piscina almeno della differenza tra una situazione senza acido cianurico e in presenza di quest’ultimo.
Nella curva con cloro libero uguale a 0.5 ppm si passa infatti ad esempio dai 5 minuti con 25 ppm di acido cianurico ai 15 minuti con 45 ppm di acido cianurico.
A 70 ppm di acido cianurico servono 20 minuti per l’inattivazione, cioè 4 volte tanto il tempo necessario con un terzo della concentrazione.
|
|
|
Sicuramente con valori di cloro più elevati tali tempi si riducono, ma la differenza resta notevole.
Questo perché, come è stato ampiamente dimostrato, esiste una correlazione diretta tra il valore del potenziale redox ed il tempo di annientamento della carica batterica.
Non è nemmeno vero che esista una relazione diretta tra la quantità di acido cianurico immessa in acqua e l’effetto stabilizzante, poiché già con 10 ppm si ottiene l’ 87% , e con 20 ppm il 95% dell’effetto stabilizzante possibile.
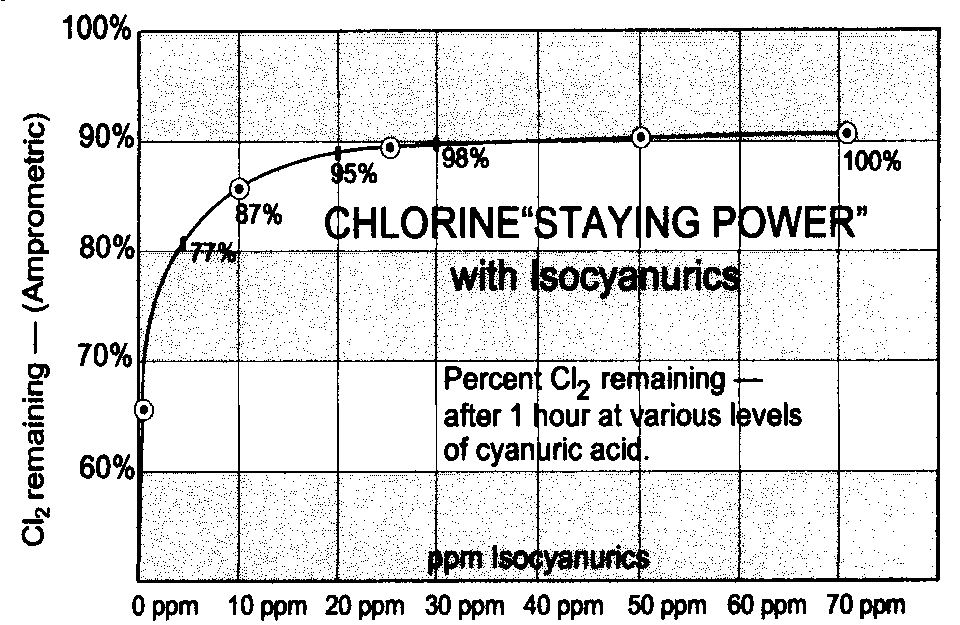
Da questa analisi è possibile trarre alcune conclusioni.
La prima è che stabilità non significa, in questo caso, maggiore attività.
Quindi questo tipo di prodotto può essere utilizzato con relativa tranquillità nelle piscine private, dove il carico inquinante è minimo, ma nelle piscine pubbliche va utilizzato con molta accortezza e solo in una situazione di reale necessità.
Nelle piscine scoperte, quindi, quando il livello di diluizione dell’inquinamento è sufficientemente elevato (quindi se il ricambio d’acqua è notevole o nelle vasche molto grandi) e solo sotto un attento e costante monitoraggio.
Pare totalmente inutile utilizzarlo nelle piscine coperte, visto che in questo caso l’azione dissociativa dei raggi ultravioletti è minima e, come abbiamo visto, gli inconvenienti di una elevata concentrazione di acido cianurico sono notevoli.
Va sottolineato che l’acido cianurico non può essere eliminato in alcun modo dall’acqua di piscina, poiché non è stata ancora trovata una base innocua per gli esseri umani e ad un costo economico sopportabile.
L’unica soluzione è il frequente ed ingente ricambio d’acqua.
La legislazione italiana, attraverso l’Atto d’Intesa, prevede in merito una concentrazione di acido cianurico massima di 75 ppm (mg/litro).